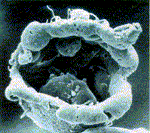
 Características de la Célula Madre Célula troncal (stem cell):
Características de la Célula Madre Célula troncal (stem cell): De forma genérica, cualquier célula que tiene la capacidad de dividirse ilimitadamente y dar lugar a diferentes tipos de células especializadas. Muchas veces se utiliza como sinónimo célula madre, es más correcto utilizar el término célula troncal como traducción del inglés stem cell. Hay varias clases de células troncales, tal como se indica a continuación:
Obtención
Células troncales embrionarias (ES, embryonic stem cells): Derivadas de la masa celular interna (MCI) del blastocisto. Han sido aisladas en conejo, ratón, hamster, oveja, cerdo, vaca, mono, macaco, marmota y en la especie humana. Las características esenciales que definen las ES en primates son (según Thomson y Gearhart, 1998):
1) que deriven de embriones preimplantatorios o periimplantatorios,
2) que tengan capacidad de sufrir una proliferación indiferenciada prolongada, y
3) que tengan un potencial de desarrollo estable capaz de producir derivados de las tres capas germinales (endodermo, mesodermo y ectodermo) después de un largo período de cultivo in vitro.
Las células ES humanas fueron aisladas por primera vez por Bongso et al. (1994). En 1998, Thomson y colaboradores publicaron un importante trabajo en el que demostraron que células pluripotentes de la MCI del blastocisto humano, tras 5 a 6 meses de proliferación indiferenciada en cultivos in vitro, mantenían la potencialidad ontogénica para formar trofoblasto y derivados de las tres capas germinales embrionarias: endodermo (epitelio intestinal), mesodermo (cartílago, hueso, músculo liso y estriado) y ectodermo (epitelio neural, ganglios embrionarios, epitelio escamoso estratificado).
Células germinales embrionarias (EG, embryonic germ cells): Derivadas de células germinales primordiales, que constituyen la línea germinal del organismo una vez separadas de la línea celular somática, y darán lugar a las células germinales (espermatozoides y óvulos). In vivo pueden originar células de teratomas embrionarios, mientras que in vitro dan lugar a las células germinales embrionarias, tal como obtuvo el grupo del Dr. Gearhart (Shamblott et al., 1998).
Células de carcinomas embrionarios (EC, embryonal carcinoma cells): Derivadas de células cancerosas de tumores embrionarios (teratocarcinomas).
Células troncales de la MCI de embriones somáticos obtenidos por transferencia de núcleos procedentes de células embrionarias, fetales o adultas a un ovocito enucleado de la propia especie humana o de otra especie. Células troncales procedentes del organismo adulto (AS, adult stem cells): En el proceso de desarrollo normal del organismo adulto tiene lugar un proceso continuado de división celular para mantener constante el número de células diferenciadas de determinados tejidos que están sometidos a un desgaste natural (daño, enfermedad o muerte celular). Las células que tienen un elevado ritmo de recambio (turnover) son reemplazadas a través de un proceso regulado de proliferación, diferenciación y muerte programada (apoptosis). Tal es el caso, por ejemplo, de las células troncales hematopoiéticas de la médula ósea y de las células epiteliales de la piel o del intestino delgado. Estos tejidos contienen subpoblaciones de células troncales encargadas de reemplazar a las células diferenciadas de corta vida.
USO(S) DE LAS CÉLULAS MADRES.En algunos tejidos u órganos puede haber células troncales capaces de reactivar su programa genético como respuesta a determinadas señales de estimulación y dar lugar a alguno, pero no todos, de los linajes celulares posibles. Es decir, se trataría de células multipotentes con un grado potencial de diferenciación inferior al de las células pluripotentes. Tal podría ser el caso de las células troncales neuronales y de las células troncales del mesénquima. Estas últimas pueden proliferar como células indiferenciadas, pero tienen la capacidad de dar lugar a diversos tejidos del mesénquima, tales como el hueso, cartílago, tendón, músculo y estroma medular.
Las células troncales neuronales están siendo objeto de intensos estudios para el tratamiento mediante trasplante celular de enfermedades neurodegenerativas (trasplante de tejido fetal a cerebros adultos dañados), incluso se pueden modificar genéticamente o inducir la expresión de determinados genes antes de realizar el trasplante al paciente. Tal sería el caso de seleccionar células estimuladas para producir dopamina en tratamientos de la enfermedad de Parkinson. Por otro lado, en 1999, Vescovi y colaboradores (Bjornson et al., 1999) demostraron en ratón que células troncales neurales –células pluripotentes precursoras de las neuronas, los astrocitos y los oligodendrocitos- podían transformarse en células troncales hematopoiéticas.
El establecimiento de cultivos celulares de tejidos humanos en el laboratorio es a veces difícil y en determinados casos incluso imposible. Por ello, desde el punto de vista clínico sería innegable el avance que supondría la posibilidad de poner a punto técnicas que permitieran obtener cualquier tipo de cultivos de tejidos y, acaso, de órganos. En este contexto, no cabe duda que el uso de las células troncales puede resultar fundamental. En lo que sigue, haremos referencia únicamente a la posible utilización de las células troncales embrionarias, germinales y adultas.
ASPECTOS BIOTECNOLÓGICOS Embriones humanos y cultivos de tejidosLa utilización de la terapia celular, basada en la transferencia de células o tejidos a los tejidos u órganos dañados, es una de las grandes esperanzas de la Medicina del futuro. En este contexto, no cabe duda que el uso de las células troncales para establecer cultivos de tejidos puede resultar fundamental. La prestigiosa revista Science (vol. 286: 2267, 17 diciembre 1999) así lo consideraba al incluir esta realidad experimental como uno de los temas estrellas de la investigación del pasado año 1999.
Utilización de las células troncales embrionales (ES)Es evidente la posible utilización de las células ES en Medicina como terapia celular directa o como productoras de cultivos de tejidos in vitro para sustituir in situ los tejidos u órganos dañados. ¿De dónde pueden obtenerse las células ES? Esencialmente de tres fuentes:
1) de embriones producidos por fecundación in vitro (FIV) con el único propósito de obtener cultivos de tejidos a partir de las células de la masa celular interna (MCI) del blastocisto.
2) de la MCI de embriones sobrantes de programas de FIV.
3) de la MCI de embriones somáticos obtenidos por técnicas de clonación mediante transferencia de núcleos (método idóneo para evitar el rechazo inmunológico del trasplante al facilitar un posible autotrasplante). Este sería el caso de la aplicación de la técnica de clonación no reproductiva con fines terapéuticos.
El procedimiento para generar células madre embrionarias (pasos 1-5) se inicia con el cultivo de un embrión en estudio de blastocito, fase precoz del desarrollo. Se ha abierto el que se muestra en la micrografía (izquierda), para mostrar la masa celular interna. Las células derivadas de las células madre embrionarias en un futuro podrían administrarse a pacientes (pasos 6 y 7). (Fuente: Pedersek, K.A. 1999. Investigación y Ciencia, 273:64-69).La clonación no reproductiva en el horizonte terapéuticoEl establecimiento de cultivos celulares de tejidos humanos en el laboratorio es a veces difícil y en determinados casos incluso imposible. Por ello, desde el punto de vista clínico sería innegable el avance que supondría la posibilidad de poner a punto técnicas que permitieran obtener cualquier tipo de cultivos de tejidos y, acaso, de órganos.
Esto es lo que se pretende hacer con la técnica de clonación no reproductiva. Se trata, por tanto, de transferir el núcleo de una célula somática diferenciada al citoplasma de un ovocito previamente enucleado, convirtiéndolo así en el equivalente de un cigoto que puede iniciar un proceso de desarrollo embrionario normal. Sin embargo, el destino de este embrión no es el de ser transferido al útero de una mujer para dar lugar tras la gestación al nacimiento de un individuo clónico de la persona a quien perteneciera la célula somática donadora del núcleo, sino el de mantenerlo en el laboratorio durante un tiempo máximo de catorce días a partir del momento de la transferencia del núcleo y utilizar sus células troncales pluripotentes para tratar de establecer en el laboratorio determinados cultivos de tejidos u órganos (esto último parece, hoy por hoy, más difícil de conseguir). Es fácil imaginar lo que supondría para un paciente poder ser trasplantado con su propio tejido (u órgano si fuera el caso), evitando cualquier problema de rechazo inmunológico.
Aspectos éticos y legales de la clonación no reproductivaDentro de la clonación no reproductiva, parece claro que no podría ponerse reparo ético alguno a la utilización de la técnica de transferencia de núcleos en cultivos celulares humanos en un intento de establecer un cultivo de tejidos y –si fuera posible- de órganos. Sin embargo, la obtención de un embrión artificial por transferencia de núcleo plantea el problema ético de haber creado un embrión humano que ha de ser destruido para poder establecer los cultivos celulares deseados. Es obvio que en el juicio ético de esta situación, el punto de partida estará condicionado por la valoración que se tenga a priori sobre el "estatuto del embrión" durante los primeros catorce días de desarrollo cuando todavía no tiene fijadas las propiedades de unicidad (ser único e irrepetible) y de unidad (ser uno solo) que determinan su individualidad. Por ello, para unos la clonación no reproductiva será éticamente aceptable mientras que para otros será rechazable.
Desde el punto de vista de las declaraciones institucionales y de la normativa legal hay que decir que tanto la Declaración Universal de la UNESCO sobre el Genoma Humano y los Derechos Humanos de 11 de noviembre de 1997 (Art.11. "No deben permitirse las prácticas que sean contrarias a la dignidad humana, como la clonación con fines de reproducción de seres humanos") como la Convención Europea sobre los Derechos Humanos y la Biomedicina (Protocolo Adicional de 12 de enero de 1998, Art.1.1. "Se prohibe toda intervención que tenga por finalidad crear un ser humano genéticamente idéntico a otro ser humano vivo o muerto") condenan y prohiben, respectivamente, la clonación reproductiva, pero no hacen alusión a la clonación no reproductiva.
Es importante resaltar que cuando se afirma que las declaraciones anteriores no aluden a la clonación no reproductiva se está aceptando implícitamente que en las expresiones "crear un ser humano" o "clonar un ser humano" incluidas en los mencionados textos se excluye al embrión humano preimplantatorio (de menos de catorce días) porque no es todavía un ser humano. Esta es una cuestión que se viene debatiendo desde hace muchos años en foros interdisciplinares.
Aspectos éticosDesde el punto de vista ético habría que plantearse algunas cuestiones, tales como:
 ¿El estatuto del embrión somático es igual al estatuto del embrión gamético?
En relación con la técnica de clonación no reproductiva cabría preguntarse si el núcleo de la célula diferenciada que se transfiere es totipotente o solamente pluripotente. La diferencia es importante porque en el segundo caso el embrión somático producido no podría originar el trofoblasto y, en consecuencia, no podría decirse que el embrión somático es totalmente equivalente al embrión gamético al no poder desarrollar un proceso de gestación normal. Utilizando este argumento, algunos autores concluyen que el embrión somático no debe ser considerado como un embrión sino como un derivado de un cultivo de células troncales. No obstante, los experimentos de clonación por transferencia de núcleos de células diferenciadas realizados con éxito a partir de 1997 en la oveja "Dolly" y en otras especies de mamíferos (vaca, cabra, cerdo y ratón) parecen indicar que lo mismo sucedería en la especie humana, por lo que habría que aceptar que los embriones somáticos son de la misma naturaleza que los embriones gaméticos y, por tanto, comparten el mismo estatuto.
 Los blastómeros totipotentes de un embrión de varias células (2, 4, 6, 8) o de una mórula de 16 células pueden dar lugar en el blastocisto al embrioblasto (masa celular interna, MCI) o al trofoblasto. ¿Cuándo quedan programados los blastómeros como precursores del embrioblasto o del trofoblasto? ¿Se podría decir que es diferente el valor ético de los blastómeros en función de que algunos de ellos no darán lugar a parte alguna del embrión –y, por tanto, del individuo– sino solamente a estructuras extraembriónicas?
 Un razonamiento similar puede hacerse respecto a las células que constituyen el embrioblasto puesto que unas darán lugar al epiblasto, del que derivará el embrión, y otras al hipoblasto que producirá estructuras extraembriónicas (endodermo extraembriónico ® saco vitelino ® mesodermo extraembriónico). Aún más, dentro del epiblasto también habría que distinguir entre las células que originarán el disco embrionario, que dará lugar al embrión propiamente dicho del que derivará el feto y después el individuo, y las que se transformarán en el ectodermo amniótico.
Aspectos legalesDesde el punto de vista legal la situación es diferente según los países, tal como se indica a continuación:
a) Estados Unidos
En Estados Unidos y a requerimiento del Presidente Clinton, la Comisión Nacional Asesora de Bioética, en su informe Ethical Issues in Human Stem Cell Research (Septiembre, 1999) concluía que la utilización de fondos federales para el uso y derivación de células troncales embrionarias (ES) y células germinales embrionarias (EG) debería ser limitada a dos fuentes de tales materiales: los embriones sobrantes de programas de FIV y los fetos abortados. Se desaconsejaba, por el contrario, la subvención federal de investigaciones con células ES procedentes de embriones creados por FIV con tal único propósito de su utilización experimental posterior o de embriones obtenidos mediante técnicas de clonación por transferencia de núcleos a ovocitos (embriones somáticos). Aunque la recomendación del Comité se refiere exclusivamente a la subvención con fondos federales de este tipo de experimentación, sin embargo señala el informe que sería de desear que las instituciones privadas siguieran las mismas normas que se proponen en él.
b) Francia
En Francia, la ley nº 94-654, de 29 de julio de 1994, relativa a la donación y utilización de elementos y productos del cuerpo humano y a la asistencia médica en la reproducción y en el diagnóstico prenatal, "prohibe la concepción in vitro de embriones humanos con fines de estudio, investigación o experimentación" (Artículo L. 152-8).
En el Artículo 21 la ley establece que "será objeto [ ...] de un nuevo examen por el Parlamento dentro del plazo máximo de cinco años a partir de su entrada en vigor". Con tal motivo, el Consejo de Estado emitió un informe sobre Les lois de Bioéthique: cinq ans aprés, que fue adoptado por la Asamblea General del Consejo de Estado el 25 de noviembre de 1999. En dicho informe se plantea la autorización, bajo condiciones estrictas, de realizar investigaciones con embriones in vitro, poniendo de relieve la necesidad de encontrar un nuevo punto de equilibrio entre el respeto del comienzo de la vida que, en su acepción más estricta, conduce a la prohibición de investigar en el embrión in vitro, por un lado, y el derecho de las personas afectadas por enfermedades muy graves a que la investigación médica progrese de manera que pueda beneficiarles, por otro lado. Se trata –dice el Informe– de conciliar dos principios éticos esenciales. Dado que la creación de embriones para el único propósito de la investigación supondría un cambio radical con relación a los fundamentos de la propia ley francesa e iría en contra del Artículo 18 de la Convención Europea sobre los Derechos Humanos y la Biomedicina, el Consejo de Estado se inclina por autorizar la investigación solamente en embriones sobrantes de programas de FIV, argumentando que "la donación de embriones sobrantes para la investigación no parece contrario al respeto del ser humano con la condición de que la pareja que ha producido estos embriones consienta formalmente en esta donación". En definitiva, dice el Informe que "aunque hay una diferencia de principio, que es conveniente señalar, entre el cese de la conservación y, por tanto, la ‘muerte natural’ del embrión y las investigaciones sobre el mismo que producirán su destrucción, parece posible dejar a los genitores, después de ser informados con precisión de las consecuencias de su decisión, la libertad de elegir entre cesar la conservación y realizar la investigación con sus embriones". El Consejo de Estado también propone una vigencia de cinco años para su nueva propuesta.
c) Reino Unido
En Gran Bretaña ha surgido la polémica al haber aprobado el Gobierno en Agosto de 2000 la autorización de la creación de embriones mediante la técnica de clonación con el propósito de utilizar las células troncales pluripotentes de la MCI para establecer los cultivos de tejidos. En estos momentos todavía no se ha pronunciado el Parlamento sobre la propuesta del Gobierno
d) Comunidad Europea
En la Comunidad Europea hay que mencionar la Directiva Europea relativa a la protección jurídica de las invenciones biotecnológicas (31 de julio de 1998) que prohibe patentar la técnica de clonación reproductiva como contraria a la moral y al orden público (Art.6). Sin embargo, en este contexto, es importante señalar el error que se produjo en la Oficina Europea de Patentes (OEP) de Munich al conceder en 1999 la patente EP 0695351 sobre "aislamiento, selección y propagación de células troncales transgénicas animales" a la Universidad de Edinburgo y la compañía biotecnológica australiana Stem Cell Sciences, ya que la OEP no se apercibió de que en la solicitud de la patente se hacía referencia también a los seres humanos puesto que incluía el siguiente párrafo: "En el contexto de este invento, el término ‘célula animal’ trata de incluir todas las células animales, especialmente las de mamíferos, incluyendo las humanas". Al parecer el error se originó porque en la terminología usada en inglés (transgenic animal) "animal" incluye la noción de humano, mientras que la traducción alemana o francesa de "animal" no incluye lo humano. Por esta razón, al faltar en la patente el calificativo "non-human", la licencia cubre también la manipulación genética de células troncales humanas. La cuestión es que una vez concedida la patente, la OEP no la puede modificar, aunque sí se pueden presentar reclamaciones en contra en un plazo de nueve meses, como parece que se ha hecho.
e) España
En España, la Ley 35/1988 sobre Técnicas de Reproducción Asistida prohibe la experimentación con embriones viables así como la obtención de embriones con fines distintos a la reproducción. Por otro lado, la situación legal respecto a la clonación es la siguiente: Aunque el Código Penal (1995) declara punible en su Art. 161.2 "... la creación de seres humanos idénticos por clonación u otros procedimientos dirigidos a la selección de la raza" y, además, España firmó el Convenio Europeo sobre los Derechos Humanos y la Biomedicina y su Protocolo Adicional, en cualquier caso tales prohibiciones no incluyen a la clonación no reproductiva. Sin embargo, dado que la técnica de clonación no reproductiva considerada implicaría la producción de un embrión cuyo destino no es la procreación, parece lógico aceptar que le sería aplicable, por analogía, el Art.161.1 del Código Penal que castiga a "... quienes fecunden óvulos humanos con cualquier fin distinto a la procreación humana", si se acepta, como se señalaba anteriormente, la equivalencia de los embriones somáticos y los embriones gaméticos.
En este contexto, parece oportuno recoger aquí la opinión ética de la Comisión Nacional de Reproducción Humana Asistida (CNRHA) española expresada en su I Informe Anual (Diciembre 1998) en relación con la clonación no reproductiva:
"... La obtención de un embrión artificial por transferencia del núcleo de una célula somática diferenciada de un individuo al citoplasma enucleado de un ovocito, con el objeto de establecer cultivos de tejidos (y acaso de órganos) a partir de las células troncales del embrión preimplantatorio y poder utilizarlos en la reparación de algún tejido u órgano dañado del propio u otro individuo, plantea el problema ético de haber creado un embrión humano que ha de ser destruido para poder establecer los cultivos celulares deseados. Es obvio que en el juicio ético de esta situación, el punto de partida estará condicionado por la valoración que se tenga a priori sobre el estatuto del embrión preimplantatorio y del momento en que se considere que comienza una vida independiente a partir de una vía de reproducción distinta a la habitual. Se trata de un debate en el que la posición de distintos miembros de la Comisión es diferente y que, como se ha mencionado en otros casos, no se ha cerrado todavía. Por otra parte, habría que tener en cuenta que se estaría creando un embrión para experimentación, con los impedimentos legales que ello conlleva conforme a nuestra propia legislación.
En cualquier caso, no hay que olvidar que, como se indicaba anteriormente, la utilización de la clonación no reproductiva puede ser innecesaria si llegan a hacerse realidad clínica los datos experimentales que se van acumulando, y que parecen indicar la posibilidad de establecer los cultivos de tejidos a partir de células troncales que están presentes en los órganos adultos. Esta técnica, que evitaría cualquier problema ético, sería claramente preferible si se llega a confirmar su posibilidad."
En cuanto a los aspectos legales de la clonación no reproductiva, el Informe de la Comisión decía que:
"Aunque, como se ha indicado, la clonación no reproductiva no está taxativamente prohibida en los documentos antes comentados, es preciso tener en cuenta que la transferencia de un núcleo diploide al citoplasma de un ovocito enucleado significa realmente la creación de un cigoto artificial capaz de evolucionar hacia un desarrollo embrionario, transformándose, por tanto, en un verdadero embrión cuyo destino, si se pretende utilizar las técnicas de clonación con estos fines no reproductivos, no es el de originar un individuo a término, sino el de utilizar sus células troncales (stem) para intentar producir cultivos de tejidos y, si fuera posible, de órganos.
Dado que el Art.161.1 del Código penal dice que "se castigará [ ... ] a quienes fecunden óvulos humanos con cualquier fin distinto a la procreación humana", sería necesario valorar si la citada expresión es extrapolable a la obtención de embriones por cualquier método (en este caso por transferencia de núcleo) con fines distintos a la procreación. Si fuera así, también estaría prohibida en nuestro país la clonación no reproductiva. Por tanto, solamente estaría permitida la clonación no reproductiva que, utilizando la técnica de transferencia de núcleo, sin embargo no produjera un embrión artificial. Eso significaría que el citoplasma de la célula receptora no debería desencadenar el programa genético de desarrollo contenido en el núcleo transferido.
En el mismo sentido, el Art.15 de la Ley 35/1988 española sobre Técnicas de Reproducción Asistida establece que "la investigación o experimentación en preembriones vivos sólo se autorizarán si se atiene a los siguientes requisitos:
 Para cualquier investigación sobre los preembriones, sea de carácter diagnóstico, o general, será preciso:
-que no se desarrollen in vitro más allá de catorce días después de la fecundación del óvulo..
 Sólo se autorizará la investigación en preembriones in vitro viables:
 -si se trata de una investigación aplicada de carácter diagnóstico, y con fines terapéuticos o preventivos
Unas y otras disposiciones pueden provocar dificultades para autorizar la clonación no reproductiva, ya que el embrión artificial creado puede tener un status equiparable al del preembrión [ ...] "
Como ya se ha comentado anteriormente, uno de los problemas que plantean las técnicas de FIV es la acumulación de embriones "sobrantes" congelados. Tal como se recoge en el I Informe Anual de la CNRHA (1998), en España se estima que hay más de 25.000, de los que una cierta proporción han sobrepasado los plazos legales de conservación y, por tanto, deberían ser destruidos. En su II Informe Anual (2000), que todavía no ha sido hecho público, la Comisión Nacional de Reproducción Humana Asistida aborda el problema de "La investigación con embriones humanos sobrantes". Aunque el autor conoce el contenido del II Informe de la Comisión Nacional de Reproducción Humana Asistida por ser vocal de ella, no puede desvelarlo porque en la fecha (Octubre de 2000) en que se está escribiendo este trabajo aún no ha sido hecho público.
En la valoración ética de esta situación debe tenerse en cuenta que se trata de decidir por el "mal menor" entre dos alternativas posibles: destruir por imperativo legal el embrión interrumpiendo su crioconservación o provocar su destrucción utilizándolo en investigación básica o aplicada, como puede ser la utilización de las células pluripotentes de su MCI para establecer determinados cultivos de tejidos. Para algunos, el "mal menor" puede ser dejar morir "con dignidad" al embrión sobrante, mientras que para otros el "mal menor" supone su utilización con fines de investigación, garantizando en cualquier caso las condiciones y requisitos de desarrollo de la investigación de acuerdo con la Convención Europea sobre los Derechos Humanos y la Biomedicina. Aunque la situación es obviamente distinta, se podría establecer la comparación con la situación de un enfermo terminal al cual podría dejársele morir con dignidad o ser utilizado con fines de investigación.
Utilización de las células germinales embrionariasDerivadas de células germinales primordiales, que constituyen la línea germinal del organismo una vez separadas de la línea celular somática, y darán lugar a las células germinales (espermatozoides y óvulos). In vivo pueden originar células de teratomas embrionarios, mientras que in vitro dan lugar a las células germinales embrionarias, tal como obtuvo el grupo del Dr. Gearhart (Shamblott et al., 1998). En la aplicación se trataría de obtener las células germinales embrionarias a partir de fetos abortados. En mi opinión, la valoración ética sería positiva siempre que no se tratara de abortos inducidos. El informe presidencial de la Comisión Nacional Asesora de Bioética norteamericana de 1999 acepta la técnica.
Utilización de las células troncales procedentes de tejidos u órganos adultos (AS)En cualquier caso, hay que tener presente la noticia esperanzadora de que podría ser innecesaria la utilización de la clonación no reproductiva si llegan a hacerse una realidad clínica los datos experimentales que vienen produciéndose de un año a esta parte que parecen indicar la posibilidad de establecer los cultivos de tejidos a partir de células troncales AS que están presentes en los propios órganos adultos. Esto evitaría cualquier problema ético y legal puesto que la manipulación sólo afectaría a las células somáticas del organismo humano sin necesidad de crear un embrión.
En el proceso de desarrollo normal del organismo adulto tiene lugar un proceso continuado de división celular para mantener constante el número de células diferenciadas de determinados tejidos que están sometidos a un desgaste natural (daño, enfermedad o muerte celular). Las células que tienen un elevado ritmo de recambio (turnover) son reemplazadas a través de un proceso regulado de proliferación, diferenciación y muerte programada (apoptosis). Tal es el caso, por ejemplo, de las células troncales hematopoiéticas de la médula ósea y de las células epiteliales de la piel o del intestino delgado. Estos tejidos contienen subpoblaciones de células troncales encargadas de reemplazar a las células diferenciadas de corta vida.
En algunos tejidos u órganos puede haber células troncales capaces de reactivar su programa genético como respuesta a determinadas señales de estimulación y dar lugar a alguno, pero no todos, de los linajes celulares posibles. Es decir, se trataría de células multipotentes con un grado potencial de diferenciación inferior al de las células pluripotentes. Tal podría ser el caso de las células troncales neuronales y de las células troncales del mesénquima. Estas últimas pueden proliferar como células indiferenciadas, pero tienen la capacidad de dar lugar a diversos tejidos del mesénquima, tales como el hueso, cartílago, tendón, músculo y estroma medular.
Las células troncales neuronales están siendo objeto de intensos estudios para el tratamiento mediante trasplante celular de enfermedades neurodegenerativas (trasplante de tejido fetal a cerebros adultos dañados), incluso se pueden modificar genéticamente o inducir la expresión de determinados genes antes de realizar el trasplante al paciente. Tal sería el caso de seleccionar células estimuladas para producir dopamina en tratamientos de la enfermedad de Parkinson. Por otro lado, en 1999, Vescovi y colaboradores (Bjornson et al., 1999) demostraron en ratón que células troncales neurales –células multipotentes precursoras de las neuronas, los astrocitos y los oligodendrocitos- podían transformarse en células troncales hematopoiéticas.
 Características de la Célula Madre
Características de la Célula Madre